Расы и штаммы хлебопекарных дрожжей. Микроорганизмы, используемые в бродильных производствах. Но далеко не все дрожжи одинаково полезны. Далее рассмотрим несколько опасных и подлых врагов виноделов - дрожжей, обладающих совсем недружелюбными свойствами
Расы дожей. В данный момент в пивоваренной промышленности пользуются такими расами, как: 11,776,41, S и P (львовская раса), а также штаммы 8а (М) и Ф-2.
Штамм 8а (М) выведен методом селекции из пивных дрожжей расы S (львовская) и предназначен для использования при низовом брожении. Эти дрожжи имеют следующие показатели: взрослые клетки односуточной культуры, выращенной на жидком охмелённом сусле с массовой долей сухих веществ 11%, имеют размеры 6,5-7,1 мкм; бродильная активность 2,04 г. СО2 на 100 мл. сусла за 7 суток при температуре 7°C; флокуляционная способность хорошая; вкус и аромат приятные.
В лабораторных условиях штамм хранят на скошенном сусло - агаре при температуре 6-7°C. Пересев производят один раз в 2-3 месяца вначале на охмелённое сусло,а затем на сусло - агар. Длительность пользования дрожжей не более 5-8 генераций. При их использовании интенсифируется процесс брожения и улучшается качество пива.
Штамм Ф-2 получён гибридизацией пивных дрожжей расы 44 и отличается от существующих штаммов пивных дрожжей способностью сбраживать углеводы сусла, состоящие из четырёх остатков моносахаров. Эти дрожжи предназначенные для проведения низового брожения, имеют размер клеток 10*4,5-6,5 мкм, бродильная активность 2,40 г. CO2 на 100 мл. сусла за 7 суток при температуре 7°C. При использовании этого штамма получают глубоковыброженное пиво с повышенной стойкостью.
Так же существуют и новые расы дрожжей.
Пивоваренные дрожжи "Saccharomyces cerevisiae" как верховые, так и низовые широко используются для сбраживания солодового сусла и получения пива.
В производственных условиях штаммы дрожжей "Saccharomyces cerevisiae" культивируются при температуре 25-30oС и оптимальном значении pН 4,6-5,5, по своим физико-биохимическим особенностям сбраживают глюкозу, сахарозу, мальтозу, рафинозу, и слабо галактозу, при выращивании усваивают следующие источники углерода: глюкозу, галактозу, сахарозу, мальтозу, рафинозу, мелицитозу, этанол, молочную кислоту и слабо трегалозу и а-метил-д-глюкозид. Нитраты не ассимилирует. Способ, условия и состав среды для хранения и размножения используется стандартный, тоесть разбавленное пивное сусло, температура 25-30oС и pН 4,5-5,5.
Хранение на твердом сусло-агаре, размножение на жидком разбавленном сусле, пересевы при хранении 1-2 раза в год при условии хранения культуры в холодильнике.
Известны различные штаммы дрожжей "Saccharomyces cerevisiae", в которых наблюдается индивидуальная изменчивость внутри вида, что приводит к получению пива с различными оттенками вкуса.
Известны, например, дрожжи "Saccharomyces cerevisiae" расы Пильзенская, расы 776 типа Фроберга, способные сбраживать охмеленное пивное сусло с получением пива светлых сортов.
Дрожжи расы 776 считаются особенно пригодными для сбраживания сусла, приготовленного с добавкой несоложеных материалов или из солода, полученного проращиванием ячменя с невысокой степенью прорастаемости.
Культура дрожжей расы 776 обладает конечной степенью сбраживания сусла 75-77%, время главного брожения 6-8 сут.
Известно применение низовых дрожжей "Saccharomyces cerevisiae" расы 308 для получения пива светлых сортов хороших вкусовых качеств. Процесс главного брожения составляет 7-10 суток. При брожении дрожжи собираются хлопьями и оседают на дно бродильного чана, образуя плотный осадок. Конечная степень сбраживания сусла составляет 82-83%.
Штамм "Saccharomyces cerevisiae" Д-202 депонирован во Всероссийском научно-исследовательском институте сельскохозяйственной микробиологии Российской академии сельскохозяйственных наук под номером 11, хранится в коллекции культур микроорганизмов.
Штамм характеризуется следующими культурально-морфологическими признаками. Односуточная культура дрожжей на жидком сусле представляет собой одиночные округло-овальные и вытянутые клетки с почками размерами (5,0-7,0), (7,5-10,0) мкм. На дне пробирки образуется плотный осадок. На сусло-агаре образует гладкие выпуклые конусовидные колонии беловато-кремового цвета пастообразной консистенции с ровным краем. На ацетатной среде на четвертый день образует сумки со спорами.
Рост на безвитаминной среде отсутствует. Штамм Д-202 является ауксотрофом по биотину.
Штамм сохраняется методом пересевов на слегка скошенном солодовом сусле - агаре с 7% сухих веществ (pН 5,0-5,5), разлитом высоким слоем (по 10 мл) в пробирки. Пересевы на свежие среды проводят один раз в 2-3 мес. Пробирки с посевами помещают на два дня в термостат при 25-30oС. После этого пробирки закрывают пергаментными колпачками и ставят в холодильник при 5oС с пересевами 1-2 раза в год.
Клетки штамма сбраживают солодовое охмеленное сусло с массовой долей сухих веществ от 10 до 20% при pН 4,4 при 14-18oС. Коэффициент размножения дрожжей 1:5.
Конечная степень сбраживания сусла 88,5%. Время главного брожения 3-8 сут (в зависимости от плотности сусла).
Способность к оседанию хорошая. Качество получаемого пива соответствует требованиям технических условий.
Раздел 3.Производство пива.
Глава 6. Брожение пивного сусла.
Пивные дрожжи .
Строение дрожжевой клетки . Дрожжи - одноклеточные организмы, относящиеся к классу сумчатых грибов. Форма дрожжевых клеток бывает овальной, округлой и эллиптической.
Дрожжевая клетка имеет клеточную стенку 1, под которой располагается цитоплазматическая мембрана. Мембрана обладает избирательной проницаемостью, оказывая влияние на обмен веществ между клеткой и средой.
Например, молекулы аминокислот и глюкозы проникают через мембрану быстрее, чем ионы металлов, которые меньше по размеру. Внутри клетки содержится круглое или овальное ядро 2, окруженное двойной мембраной. Внутри ядра расположено ядрышко. Ядро необходимо для процессов обмена веществ, обеспечивающих рост и
размножение дрожжей.
Основой клетки является цитоплазма 3, представляющая собой вязкую, слегка желтоватую жидкость. Она выполняет многие функции так, например, первая стадия дыхания и спиртовое брожение протекают непосредственно в цитоплазме. Здесь же находятся структурные элементы клетки: вакуоль 4, митохондрии 5, рибосомы 6. Митохондрии- это очень мелкие частицы каплеобразной формы, в которых происходят процессы, связанные с окислительным обменом веществ. Рибосома представляет собой пузырек, окруженный мембраной. Рибосомы являются местом, где происходит синтез белков. Вакуоли- полости, наполненные клеточным соком и отделенные от цитоплазмы вакуолярной мембраной. В них находится метахроматин, обусловливающий рост и размножение дрожжевых клеток. В вакуолях протекают окислительно –восстановительные процессы.
Величина дрожжевых клеток зависит от расы, физиологического состояния дрожжей и состава питательной среды. Прессованные дрожжи содержат около 30% сухих веществ и 70% воды. В сухих веществах дрожжей содержится 90-95% органических веществ и 5-10% неорганических веществ. Среди органических веществ имеются белки и азотсодержащие вещества-54-56%, углеводы-24-40%, жиры-2-4% (к массе сухих веществ). основная часть углеводов представлена гликогеном(запасное вещество), сходным по химстроению с амилопектином крахмала. Среди неорганических веществ около половины фосфорной кислоты и 1/3 калия.
В золе дрожжей содержится (в %): Р 2 О 5 –47-53, К 2 О- 28-40; СаО-0,4 –11,3; Мg О-3,0-7,4;SiO 2 -0,28- 0,73; SiO 3 - 0,09-0,74; Сl –0,1-0,65. Кроме того, в небольшом количестве имеются S , Zn , Mn , Cu , Fe .
Фосфорные соединения имеют важное значение в обмене веществ дрожжевых клеток, так как входят в состав промежуточных веществ спиртового брожения, а калий играет первостепенную роль в построении молекул белков и углеводов. Дрожжи богаты витаминами группы В, содержат эргостерин(провитамин D ) и др. В дрожжах содержатся различные ферментные системы, участвующие в процессах гидролиза и синтеза, а также в процессах брожения и дыхания.
Стадия роста дрожжей . Ростом дрожжей называют увеличение числа их клеток, т.е. – размножение. Дрожжевые клетки при нормальных условиях размножаются почкованием. Материнская клетка образует почку, которая вырастает в дочернюю клетку. При недостатке питательных веществ или при других неблагоприятных условиях внутри клетки образуются перегородки, и клетка распадается по этим перегородкам, образуя споры. В среде с хорошими условиями питания споры прорастают и образуют новые дрожжевые клетки. Пивное сусло содержит все необходимые вещества для размножения клеток, поэтому при сбраживании сусла дрожжи размножаются только почкованием, не образуя спор.
После введения дрожжей в сусло наблюдаются их количественные и качественные изменения. Количество дрожжей Увеличивается в несколько раз, однако их концентрация в диспергированном состоянии вначале увеличивается, достигая максимальной величины, а затем снижается. Размножение дрожжей при сбраживании пивного сусла проходит в несколько этапов. На кривой роста можно выделить несколько этапов. (По вертикали- число дрожжевых клеток, по горизонтали – время.)
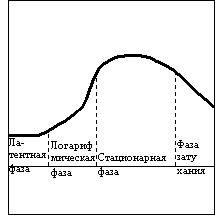 В
начальной фазе, называемой латентной или лаг- фазой (задержка роста), дрожжи
приспосабливаются к новой среде и подготавливаются к размножению. Эту фазу
условно делят на две части: фазу действительного покоя, когда клетки
приспосабливаются к среде,и фазу
постепенного начала размножения. Продолжительность латентной фазы для пивных
дрожжей 1-1,5 сут. В ней клетки увеличиваются в объеме и удлиняются, растет
доля почкующихся клеток.
В
начальной фазе, называемой латентной или лаг- фазой (задержка роста), дрожжи
приспосабливаются к новой среде и подготавливаются к размножению. Эту фазу
условно делят на две части: фазу действительного покоя, когда клетки
приспосабливаются к среде,и фазу
постепенного начала размножения. Продолжительность латентной фазы для пивных
дрожжей 1-1,5 сут. В ней клетки увеличиваются в объеме и удлиняются, растет
доля почкующихся клеток.
При следующей фазе, называемой логарифмической, скорость размножения дрожжей максимальная, все клетки активны и находятся в бродящей среде во взвешенном состоянии.
После логарифмической фазы наступает стационарная фаза, когда размножение клеток замедляется, при этом скорость отмирания и размножения уравновешиваются, в результате чего число живых клеток остается без изменения.
Последняя фаза, называемая фазой затухания, характеризуется снижением активности клеток, что обусловлено уменьшением массы питательных веществ и увеличением количества продуктов обмена. Размножение прекращается, клетки отмирают и оседают на дно бродильного аппарата.
В живой дрожжевой клетке жизнедеятельность поддерживается различными биохимическими процессами, а при её отмирании согласованность этих процессов нарушается и начинается автолиз, т.е. распад клетки под действием собственных ферментов. При этом структура клеток нарушается, повышается активность у одних ферментов и ослабевает у других.
Например, гидролитические ферменты активизируются, а ферменты дыхания и брожения погибают. При автолизе дрожжей происходит распад белковых веществ, углеводородов, жиров, органических фосфорных соединений, образуются низкомолекулярные продукты распада, которые диффундируют через стенки клеток в пиво и изменяют его вкус. При незначительном автолизе появляется слабый дрожжевой привкус, а при сильном автолизе - горький посторонний вкус. Выделяемые при автолизе азотистые вещества могут быть коллоидного помутнения пива.
Расы пивных дрожжей. В пивоваренном производстве используют только культурные дрожжи, которые относятся к семейству сахаромецетацеа (Saccharomycetaceae ) и к роду сахаромицес (Saccharomyces ). Различают дрожжи низового брожения сахаромицес карлсбергенсис (Saccharomyces carlsbergensis ) и дрожжи верхового брожения – сахаромицес церевизие (Saccharomyces cerevisiae ).
Первоначально были известны дрожжи верхового брожения, так как брожение проходило только при обычной температуре (как в виноделии, хлебопечении). желая получить напитки, насыщенные углекислым газом, стали проводить брожение при низких температурах. Под влиянием изменившихся внешних условий и были получены дрожжи низового брожения с определенными свойствами.
В пивоварении применяют разновидности дрожжей, отличающихся друг от друга одной или несколькими особенностями. Их получают из одной клетки. такие культуры называют расами (штаммами).
Дрожжи верхового брожения в процессе интенсивного броения всплывают на поверхность сбраживаемой жидкости, накапливаются в виде слоя пены и остаются в таком виде до конца брожения. Затем они оседают, образуя весьма рыхлый слой на дне бродильного аппарата. по своей структуре эти дрожжи относятся к пылевидным дрожжам, не слипающимися между собой в отличие от хлопьевидных низовых дрожжей, оболочки которых клейкие, что приводит к слипанию(агглютинация) и быстрому осаждению клеткок.
Дрожжи низового брожения не переходят в поверхностный слой пива- пену, а быстро оседают на дне бродильного аппарата.
Способность дрожжей к хлопьеобразованию имеет важное значение для технологии сбраживанияпивного сусла, так как способствует ускорению осветления пива и облегчает съём дрожжей из бродильного аппарата после брожения с последующим использованием их в качестве семенных дрожжей. Низкая температура при брожении содействует хлопьеобразованию.
Реакция среды сильно влияет на свойства дрожжей. Например, в кислой среде при рН менее 3 и в щелочной при рН более 8 хлопьевидные дрожжи становятся пылевидными. Хлопьевидные дрожжи по сравнению с пылевидными имеют более крупные клетки, меньше подвержены автолизу, дают большой прирост биомассы, обладают меньшей бродильной активностью, образуют меньше диацетила и высших спиртов в пиве, что положительно сказывается на его качестве.
Дрожжи низового брожения отличаются от дрожжей верхового брожения тем, что они полностью сбраживают раффинозу. Дрожжи низового брожения имеют оптимальную температуру для роста25 - 27С, минимальную 2-3С, а при 60-65С они отмирают. Максимальное развитие низовых дрожжей происходит при рН4,8-5,3. Кислород, растворенный в сусле,способствует размножению дрожжей,в то время как продукты брожения (этиловый спирт, диоксид углерода, высшие спирты, ацетальдегид, кислоты), а также повышенная концентрация сахара угнетают развитие дрожжей.
Пивные дрожжи должны отвечать следующим требованиям: Быстро сбраживать сусло, хорошо образовывать хлопья и осветлять пиво в ходе брожения, придавать пиву чистый вкус и приятный аромат.
Бродильную активность дрожжей определяют по степени сбраживания сусла. Степень сбраживания (V ) –это показатель, выраженный в процентах характеризующий отношение массы сброженного экстракта (Е-е) к массе сухих веществ в начальном сусле (Е):V = ((E -e )100)/ Е,Где е- содержание в пиве экстрактивных веществ, % к массе пива.
По степени сбраживания дрожжи делятся на сильно-, или высокосбраживающие (степень сбраживания 90-100%), среднесбраживающие (80-90%), слабо, или низкосбраживающие (менее 80%).
К сильносбраживающим относятся дрожжи рас: 11, F (получена в Чехии), штамм 8а(М). Дрожжи расы 11 нетребовательны к качаеству сырья, хорошо оседают, пиво характеризуется полным вкусом. Дрожжи расы F хорошо осветляют пиво, рпидают ему приятный аромат, устойчивы к инфекции. Дрожжи штамма 8а (М) имеют высокую бродильную активность, повышенный коэффициент размножения, хорошо оседают.Использование этих дрожжей дает возможность сократить длительность главного брожения с 7 до 5 сут и получить пиво с хорошим вкусом.
К среднесбраживающим относятся дрожжи рас 776, 41, 44, S (львовская), Р (Чехия),
А (рижская). Дрожжи расы 776 неприхотливы к сырью, их можно использовать для приготовления пива с применением несоложеных материалов. Готовое пиво имеет удовлетворительный вкус резкую хмелевую горечь. Дрожжи рас 41, 44, S , Робладают хорошей способностью оседания, вкус пива чистый мягкий, Дрожжи расы 44 дают возможность получать хорошее пиво при применении воды повышенной жесткости. Дрожжи рас F , A хорошо осветляют пиво, устойчивы к инфекции.
Для темных и специальных сортов пива применяют дрожжи верхового брожения.
Требования, предъявляемые к качеству дрожжей, не всегда удовлетворяются одной расой, поэтому в производстве применяют смесь рас или ведут брожение сусла отдельно на разных расах, а затем смешивают молодое пиво.
Разведение дрожжей чистой культуры .
Под разведением понимают увеличение массы дрожжей в количестве от массы в одной пробирке до массы маточных, необходимой для внесения в бродильный аппарат.
Весь процесс разведения состоит из двух стадий: лабораторной (разведение дрожжей в лаборатории) и цеховой (разведение дрожжей в отделении чистой культуры).
Лабораторная стадия состоит из нескольких последовательных пересевов. Вначале чистую культуру из пробирки пересевают в колбочки на стерильное сусло, затем проводят пересев дрожжей со стерильным сброженным суслом на новое стерильное сусло, объем которого от пересева к пересеву увеличивается в несколько раз. Лабораторная стадия заканчивается сбраживанием 6 л сусла в медной колбе Карлсберга в течении 5-6 сут при 7-8 о С.
Цеховая стадия- это разведение дрожжей на стерильном охмеленном сусле в специальных аппаратах.
На рисунке показана установка Грейнера для разведения чистой культуры дрожжей в цехе (трубопроводы не показаны). Установка состоит из стерилизатора 4 , двух бродильных цилиндров 3,число которых изменяется в зависимости от количества используемых дрожжей, резервуара для предварительного брожения 1 и посуда 2 для посевных дрожжей.
Стерилизатор и резервуар предварительного брожения оборудованы змеевиками для нагревания или охлаждения сусла, воздушными фильтрами и контрольно- измерительной аппаратурой.
Бродильные цилиндры имеют сосуды для посевных дрожжей вместимостью 10 л.
Стерилизатор предназначен для кипячения
сусла (стерилизация) и последующего его охлаждения, Бродильный цилиндр- для
первой стадии размножения, резервуар предварительного брожения- для
стерилизации и охлаждения сусла, а также проведения второй стадии размножения
чистой культуры. Температура воздуха в  отделении
чистой культуры 8-9 о С.
отделении
чистой культуры 8-9 о С.
Разведение чистой культуры происходит следующим образом. В стерилизатор 4 из сусловарочного котла набирают горячее охмеленное сусло, кипятят его в течении 1 ч, затем охлаждают до8-12 о С. С помощью сжатого стерильного воздуха сусло подают в цилиндр 3, куда через специальный краниз медной колбы Карлсберга вводят чистую культуру, затем сбраживают в течении 3 сут.При этом дрожжи размножаются и увеличиваются в массе. к концу третьих суток резервуар предварительного брожения заполняют суслом, которое также нагревают до кипения, а затем охлаждают. Часть чистой культуры из бродильного цилиндра 3 отбирают на хранение в сосуд 2 для посевных дрожжей, где она хранится до до следующей разводки, а основную часть его перекачивают в резервуар 1,где осуществляют предварительное брожение при 9 о С в течение 3 сут.
В следующих циклах разведения дрожжи для посева в стерильное сусло, находящееся в бродильном цилиндре 3 берут из сосуда 2. Процесс разведения чистой культуры в установке Грейнера повторяют многократно до обнаружения в дрожжах посторонней микрофлоры.
Сбраживаемую массу из резервуара 1 перекачивают в специальный аппарат для предварительного брожения вместимостью 1000 дал, но наполненный на 1/3 суслом температурой 5-7 о С.Через 12 ч брожения в этот аппарат доливают еще 400 дал свежего охмеленного сусла и продолжают брожение еще 36 ч, поддерживая температуру 5-7С. Затем сбраживаемое сусло перекачивают в аппарат для главного брожения с 700 дал сусла, а через 1 сут заполняют его суслом до полной вместимости и ведут брожение обычным способом, контролируя температуру, концентрацию сусла и осветление. Осевшие при брожении дрожжи смывают, промывают холодной водой и используют в производстве как первую генерацию.
Дрожжерастительные аппараты перед началом работы стерилизуют паром в течение 45 мин под давлением 0,15- 0,17 МПа. Воздух, поступающий в стерилизатор, должен проходить через воздушные фильтры.
2 Общая характеристика и расы дрожжей, применяемых в бродильных производствах
Культурные дрожжи относятся к семейству сахаромицетов и называютсяSaccharomyces cerevisiae.
Температурный оптимум для размножения дрожжей находится в пределах 25-30°С, а минимальная температура около 2-3°С. При температуре 40°С рост прекращается и дрожжи отмирают, но низкие температуры дрожжи переносят хорошо, хотя размножение их приостанавливается. Дрожжи не погибают даже при температуре –180°С (жидкий воздух). При высокой концентрации сахара в среде жизнедеятельность дрожжей прекращается, так как при этом увеличивается осмотическое давление, при определенном значении которого наступает плазмолиз дрожжевых клеток. Плазмолизом называется сжатие клетки с последующим отслоением протоплазмы от клеточной оболочки вследствие обезвоживания клетки и связанного с этим резкого падения давления клеточного сока. Величина предельной концентрации сахара для различных рас дрожжей неодинакова.
Различают дрожжи верхового и низового брожения. В каждой из этих групп имеется несколько отдельных рас.
Дрожжи верхового брожения в стадии интенсивного брожения выделяются на поверхности сбраживаемой среды в виде довольно толстого слоя пены и остаются в таком состоянии до окончания брожения. Затем они оседают, но редко дают плотный осадок на дне бродильного сосуда. Дрожжи верхового брожения по своей структуре принадлежат к пылевидным дрожжам, не склеивающимся друг с другом в отличие от хлопьевидных дрожжей низового брожения, оболочки которых являются клейкими, что приводит к агглютинации и быстрому осаждению клеток.
Дрожжи низового брожения, развиваясь в сбраживаемой жидкости, не переходят в поверхностный слой – пену, быстро оседают по окончании брожения, образуя плотный слой на дне бродильного сосуда.
Отличительным признаком является способность дрожжей низового брожения полностью сбраживать рафинозу, тогда как большинство дрожжей верхового брожения рафинозу совершенно не расщепляет, и лишь некоторые виды могут сбраживать ее только на одну треть. Это основное различие объясняется тем, что в ферментном комплексе названного типа дрожжей содержится α-галактозидаза.
Из культурных дрожжей к дрожжам низового брожения относится большинство винных и пивных дрожжей, а к дрожжам верхового брожения – спиртовые, хлебопекарные и некоторые расы пивных дрожжей. Первоначально были известны только дрожжи верхового брожения, так как брожение всяких соков происходило при обычной температуре. Желая получить напитки, насыщенные СО 2 , человек стал вести брожение при низкой температуре. Под влиянием изменившихся внешних условий получились дрожжи низового брожения с их свойствами, получившие широкое распространение.
Кроме общих свойств, дрожжи, используемые в том или ином производстве, обладают специфическими показателями. Более того, в одном и том же производстве применяются разновидности, различающиеся одной или несколькими особенностями. Их выводят из одной клетки. Такие культуры называют расами (штаммами). Каждое производство располагает несколькими расами дрожжей.
Расы дрожжей спиртового производства
В спиртовом производстве применяются те расы дрожжей верхового брожения, которые обладают наибольшей энергией брожения, образуют максимум спирта и сбраживают моно- и дисахариды, а также часть декстринов. Из дрожжей, применяемых при получении спирта из хлебно-картофельного сырья, следует назвать расы ХП, М и ХV.
При переработке мелассы на спирт применяют расы Я, Л, В, Г-67, Г-73. Эти расы относятся к семейству Saccharomyces taceae, роду Saccharomyces, виду cerevisiae.
Раса ХП выделена в 1902 году из хлебопекарных прессованных дрожжей. Клетки дрожжей этой расы круглые ияйцевидные размерами 5-6,2 х 5-8 мкм.
Развитие и размножение дрожжей расы ХП идет очень быстро. Они сбраживают глюкозу, фруктозу, сахарозу, галактозу, мальтозу, маннозу, рафинозу на одну треть и могут образовывать в сбраживаемой среде до 13%об спирта.
Раса М (Mischung – смесь), предложенная Геннебергом в 1905 году, состоит из смеси четырех рас дрожжей верхового брожения; она предназначена для сбраживания сред, содержащих смесь различных сахаров (декстринов, рафинозы), которые неодинаково сбраживаются различными дрожжами. Такая смешанная культура очень устойчива против различных ненормальных условий, встречающихся в заводской практике.
Раса ХV по технологическим признакам сходна с расой ХП. Ее применяют наряду с расой ХП для сбраживания смешанного зерно-мелассного сырья.
Из названных рас наиболее пригодной для сбраживания сусла из крахмалистого сырья является раса ХП, которая применяется также в гидролизном и сульфитноспиртовом производствах. Правда, для сбраживания сульфитных щелоков выведены специально сульфитные дрожжи, сбраживающие глюкозу, фруктозу, галактозу и маннозу.
Дрожжи, применяемые на спиртовых заводах, перерабатывающих мелассу, должны обладать специфической способностью быстро сбраживать довольно концентрированные сахарные растворы и хорошо переносить высокое содержание солей в среде. Сбраживать же растворы, содержащие большие концентрации сахара, могут так называемые осмофильные дрожжи, которые выносят очень высокое осмотическое давление.
К таким дрожжам относится раса Я, выведенная из мелассных дрожжей К.Ю. Якубовским. Раса Я обладает исключительной способностью сбраживать высокие концентрации сахара и хорошо переносит высокое содержание солей и спирта в сбраживаемом мелассном сусле. Дрожжи расы Я сбраживают глюкозу, фруктозу, сахарозу, галактозу, мальтозу; рафинозу сбраживают только частично и совершенно не сбраживают декстрины и лактозу. Раса Я относится к пылевидным дрожжам верхового брожения.
Дрожжи расы Л (Лохвицкая) близки по своим свойствам к дрожжам расы Я, но они несколько лучше размножаются и более полно сбраживают сахар.
Раса В (венгерская) подобно расе Л приспособлена к мелассной среде. Эти расы хорошо сбраживают сахарозу, глюкозу, фруктозу, а рафинозу частично.
Дрожжи рас Л и В наряду с высокими бродильными свойствами обладают также хорошей подъемной силой (способностью поднимать тесто), что позволяет выделять их из бражки и выпускать в прессованном виде в качестве хлебопекарных.
Успешное применение находят гибридные дрожжи, выведенные в Институте генетики АН СССР путем скрещивания двух видов дрожжей. Среди гибридов наибольший интерес представляют Г-67, Г-73. Гибрид 67 получен скрещиванием пивных дрожжей S-carlsbergensis с S.cerevisiae расы Я. Дальнейшее скрещивание гибрида 67 с гибридом 26 (полученным от скрещивания рас Я и ХП) дало гибрид 73. Гибриды 67 и 73 наряду с другими ферментами содержат α-галактозидазу и обладают способностью к полному сбраживанию рафинозы. Рекомендованы к применению и другие гибридные дрожжи.
Расы хлебопекарных дрожжей
В дрожжевом производстве ценятся быстро размножающиеся расы дрожжей, обладающие хорошей подъемной силой и хорошей стойкостью при хранении. Вкус хлебопекарных дрожжей должен быть чистый, цвет белый или желтоватый. Подъемная сила определяется как особенностями рас дрожжей, так и способом ведения производства. Стойкость дрожжей является свойством расы, но зависит от внутреннего состояния клеток и чистоты дрожжей.
При производстве хлебопекарных дрожжей из мелассы применяются расы VII, 14, 28 и Г-176.
Раса VII, выведенная из прессованных товарных дрожжей Томского дрожжевого завода, быстро размножается и хорошо отпрессовывается до влажности 71-72%. Дрожжи расы VII обладают хорошей подъемной силой и наибольшей стойкостью при хранении по сравнению с другими известными в заводской практике. Кроме того, эта культура является устойчивой к вредным примесям, содержащимся в мелассе.
Раса 14 предназначена для производства сухих дрожжей. Эти дрожжи отличаются плотной консистенцией при влажности 75%, высокой термоустойчивостью.
Из гибридов хлебопекарных дрожжей отобран гибрид 176, обладающий всеми положительными признаками: крупными клетками (5,6-14,0 мкм), устойчивостью к вредным примесям мелассы и высоким коэффициентом размножения, который у этой расы выше, чем у наиболее быстро размножающейся расы 14. В настоящее время проходят производственные испытания и другие перспективные гибридные расы дрожжей.
Расы пивных дрожжей
В пивоварении используют дрожжи низового брожения, приспособленные к сравнительно низким температурам. Пивные дрожжи должны быть микробиологически чистые, а также обладать способностью к хлопьеобразованию, быстро оседать на дно бродильного аппарата и давать прозрачный напиток с определенными вкусом и ароматом. К сильносбраживающим и легко дающим хлопья относятся пивные дрожжи низового брожения Фроберг (Saccharomyces cerevisiae Froberg), дрожжи рас V и 776.
На пивоваренных заводах большое распространение получили дрожжи расы 776, которая была выведена в начале XX в. Эти дрожжи считаются пригодными особенно для сбраживания сусла, приготовленного с добавкой несоложеных материалов или из солода, полученного солодованием ячменей с невысокой степенью прорастаемости. Дрожжи расы 776 –среднесбраживающие, за период главного брожения на сусле концентрацией 11% образуют примерно 2,7% СО 2 . Клетки яйцевидной формы, длиной 8-10 мкм и шириной 5-6 мкм. Прирост дрожжевой массы 1: 5,4. Способность к осветлению удовлетворительная.
Из других дрожжей на пивоваренных заводах применяются расы 11, 41, 44, S-Львовская и др, различающиеся по бродильной энергии, способности к осаждению и энергии роста.
Дрожжи расы 11 – сильносбраживающие, с хорошей способностью к осветлению. Пиво, полученное с применением дрожжей расы 11, имеет хороший вкус. Эта раса получила широкое распространение на пивоваренных заводах.
Дрожжи расы 41 – среднесбраживающие, с хорошей способностью к осаждению. При сбраживании сусла расой 41 получается мягкое пиво с чистым вкусом.
Дрожжи расы 44 – среднесбраживающие. Способность к осаждению хорошая. Сообщают пиву полноту вкуса и дают хорошие результаты при применении в производстве воды с повышенной жесткостью.
Дрожжи расы S – среднесбраживающие. Способность к осаждению хорошая. Дают пиво с мягким чистым вкусом.
Дрожжи расы Р – среднесбраживающие, хорошо осветляют пиво и обусловливают приятный чистый вкус.
Дрожжи расы F характеризуются хорошей способностью к осветлению и сообщают пиву приятный аромат. Раса устойчива к действию посторонних микроорганизмов.
Дрожжи расы А (выделены на рижском пивоваренном заводе «Алдарис») сбраживают сусло за 7-8 суток, хорошо осветляют пиво и устойчивы к инфекции.
Путем разных способов селекции во ВНИИ пивобезалкогольной промышленности получен ряд сильносбраживающих штаммов дрожжей (28, 48, 102), обладающих значительно большей бродильной энергией, чем дрожжи исходной расы 11.
Пивные дрожжи верхового брожения находят широкое применение в Англии при приготовлении Портера. Они применяются также для приготовления Берлинского светлого пива и других напитков. Для приготовления Бархатного пива применяют штамм 191 К, интенсивно сбраживающий моносахариды и мальтозу, но не сбраживающий сахарозу, рафинозу и лактозу.
Расы винных дрожжей
В виноделии ценятся дрожжи, быстро размножающиеся, обладающие свойством подавлять другие виды дрожжей и микроорганизмы и придавать вину соответствующий букет. Дрожжи, применяемые в виноделии, относятся к своеобразному виду Saccharomyces ellipsoideus. Клетки их имеют продолговато-овальную форму. Дрожжи энергично сбраживают глюкозу, фруктозу, сахарозу и мальтозу. В различных местностях и из различных молодых вин выделено несколько отличающихся одна от другой разновидностей или рас этого вида. В виноделии почти все производственные культуры дрожжей – своего, местного происхождения. К их числу относятся расы Магарач 7, Массандра 3, Пино 14, Кахури и многие другие. Наряду с этими расами применяются и некоторые иностранные, например раса Штейнберг, выделенная в Германии в 1892 и 1893 гг., и раса Шампань-Аи.
Большая часть винных дрожжей относится к дрожжам низового брожения.
Для приготовления белых столовых вин применяются расы Пино 14, Феодосия 1/19, Алиготе, Рислинг Анапский.
Раса Пино 14 имеет клетки яйцевидной формы, хорошо сбраживает виноградное сусло сахаристостью 20 % с образованием 11,57%об спирта; оптимальная температура развития и брожения 18: -25°С. Эта раса является холодостойкой и кислотостойкой; оптимальная величина рН 2,9-3,9.
Раса Феодосия 1/19 – крупноклеточная, пылевидная, очень энергичная, быстро сбраживает виноградное сусло и хорошо дображивает его; имеет широкий температурный диапазон брожения (от 9 до 35°С) и может применяться как холодостойкая и как термостойкая.
Дрожжей Алиготе имеется несколько рас, и все они сильные, с высокой энергией брожения. К энергично сбраживающим относятся и дрожжи Рислинг Анапский.
Для приготовления крепких вин применяется раса Массандра 3 с яйцевидной формой клеток, пылевидная; оптимальная величина рН 3,7-4,05; оптимальная температура брожения 18-20°С. Виноградное сусло с содержанием сахара 20% сбраживается полностью; при сбраживании концентрированного виноградного сусла (30% сахара) образует 11,8%об спирта и оставляет несброженным 8,7% сахара.
Раса Магарач 125, названная в ознаменование 125-летнего юбилея первых посадок винограда в институте «Магарач», применяется для получения крепких и десертных вин. Эта раса хорошо сбраживает высококонцентрированные виноградные сусла с содержанием сахара 27-30%, холодостойкая.
Раса Кахури 2 широко применяется для приготовления шампанских виноматериалов и вин. Виноградное сусло с содержанием сахара 20% она сбраживает с образованием 11,4%об спирта, остается несброженным 0,28% сахара. Эта раса довольно холодостойкая (при температуре 14-15°С сусло забраживает на 2-й день) и сбраживает хорошо; оптимальная величина рН 3,4-3,6.
Раса Шампанская 7, применяемая для шампанизации вина в бутылках, выделена из расы Кахури 5 и характеризуется образованием трудно взмучивающегося осадка; интенсивно сбраживает при температуре 4-9°С, хотя сусло и забраживает только на 5-6-й день.
Из винных дрожжей наиболее холодостойкой считается раса Ленинградская, а наиболее термостойкой – раса Ашхабадская 3.
В производстве хереса применяются специальные расы дрожжей, которые являются разновидностью вида Saccharomyces oviformis. Хересные дрожжи образуют на поверхности вина в неполных бочках пленку, благодаря развитию которой вино приобретает особые букет и вкус.
Путем тщательного отбора по наиболее важным производственным признакам выделено несколько рас хересных дрожжей (13, 15 и 20) с высокой пленкообразующей способностью. В дальнейшем из производства, применявшего расу Херес 20, была отселекционирована более эффективная раса Херес 20-С, которая нашла широкое применение на многих заводах по производству хереса.
В плодово-ягодном виноделии применяются селекционированные расы дрожжей, выделенные из различных плодово-ягодных соков. Плодово-ягодные соки богаты дрожжами, обладающими всеми необходимыми для производства качествами и биологически приспособленными к условиям развития в исходных плодово-ягодных соках. Поэтому штаммы дрожжей, выделенных из земляничных соков, применяются для сбраживания земляничных соков, а штаммы дрожжей, выделенных из вишневых соков, применяются для сбраживания вишневых соков и т. д.
В плодово-ягодном виноделии получили распространение следующие штаммы: яблочные 46, 58, клюквенный 17, смородиновый 16, брусничные 3, 7, 10, малиновые 7/5, 25, 28, 28/10, вишневые 3, 6, земляничные 7, 4, 9.
Названные штаммы дрожжей обеспечивают нормальный ход брожения, полноту сбраживания, быструю осветляемость и хорошие вкусовые качества вина; они сбраживают глюкозу, фруктозу, сахарозу, мальтозу, галактозу и не сбраживают лактозу и маннит.
Успешно применяются в плодово-ягодном виноделии расы дрожжей Москва 30, Яблочная 7, Вишневая 33, Черносмородиновая 7, Малиновая 10 и Сливовая 21. Чистая культура дрожжей Москва 30 рекомендуется для сбраживания клюквенного сусла; Яблочная 7 и Вишневая 33 – для сбраживания яблочного сусла; Черносмородиновая 7 и Вишневая 33 – для сбраживания черносмородинового и вишневого сусла.
4 Химизм спиртового брожения. Вторичные и побочные продукты спиртового брожения
Спиртовое брожение представляет собой цепь ферментативных процессов, конечным результатом которых является распад гексозы с образованием спирта и СО 2 и доставка дрожжевой клетке той энергии, которая необходима для образования новых веществ, используемых для процессов жизнедеятельности, в том числе для роста и размножения. По химическому характеру спиртовое брожение – каталитический процесс, происходящий под действием биологических катализаторов – ферментов.
Современная теория спиртового брожения является результатом работ многих ученых различных стран мира.
Для выяснения процессов брожения большое значение имели работы выдающихся отечественных ученых: Лебедева, Костычева, Фаворского, Иванова, Энгельгардта.
По современным представлениям, спиртвое брожение – это сложный непрерывный процесс распада сахара, катализируемый разными ферментами с образованием 12 промежуточных продуктов.
1 Начальной стадией превращения глюкозы является реакция фосфорилирования ее при участии фермента глюкозиназы. К молекуле глюкозы присоединяется фосфатный остаток от молекулы АТФ, которая находится в клетках дрожжей, и образуется глюкозо-6-фосфат, а АТФ превращается в АДФ:
С 6 Н 12 О 6 + АТФ → СН 2 О(Н 2 РО 3)(СНОН) 4 СНО+АДФ
Глюкоза Глюкозо-6-фосфат
В результате присоединения фосфатного остатка от молекулы АТФ к глюкозе реакционная способность последней возрастает.
2 Глюкозо-6-фосфат путем изомеризации под действием фермента глюкозофосфатизомеразы переходит обратимо в форму фруктозы:
СН 2 О(Н 2 РО 3)(СНОН) 4 СНО → СН 2 О(Н 2 РО 3)(СНОН) 3 СОСН 2 ОН
СН 2 О(Н 2 РО 3)(СНОН)3СОСН 2 ОН + АТФ →
Фруктозо-6-фосфат
→ СН 2 О(Н 2 РО 3)(СНОН) 3 СОСН 2 О(Н 2 РО) + АДФ
Фруктозо-1,6-дифосфат
Эфиры глюкозо-6-фосфат и фруктозо-6-фосфат образуют равновесную смесь, получившую название эфира Эмдена и состоящую на 70-75% из эфира Робисона (глюкозы) и на 25% из эфира Нейберга (фруктозы).
Образованием фруктозо-1,6-дифосфата заканчивается подготовительнаястадия спиртового брожения с переносом макроэргических фосфатных связей и с преобразованием гексозы в лабильную оксиформу, легко подвергающуюся дальнейшим ферментативным превращениям.
4 Следующим важнейшим этапом является десмолиз – разрыв углеродной цепи фруктозодифосфата с образованием двух
молекул фосфотриоз. Симметричное расположение остатков фосфорной кислоты по концам молекулы фруктозы облегчает разрыв ее углеродной цепи как раз в середине. Фруктозодифосфат распадается при этом на две триозы: фосфоглицериновый альдегид и фосфодиоксиацетон. Реакция катализируется ферментом альдолазой и обратима:
СН 2 О(Н 2 РО 3)(СНОН) 3 СОСН 2 О(Н 2 РО) → CH 2 О(Н 2 Р0 3)СОСН 2 ОН +
Фруктозо-1,6-дифосфат Фосфодиоксиацетон
СН 2 0 (Н 2 РОз) СНОНСНО (4)
З-фосфоглицериновый альдегид
Главная роль в дальнейших превращениях при спиртовом брожении принадлежит 3-фосфоглицериновому альдегиду, но в сбраживаемой жидкости он обнаруживается лишь в незначительном количестве. Это объясняется взаимным переходом ке-тозного изомера в альдозный и обратно под действием фермента триозофосфатизомеразы (5.3.1.1)
СН 2 0 (Н 2 Р0 3) СОСН 2 ОН;£ СН 2 0 (Н 2 Р0 3) СНОНСНО
Фосфодиоксиацетон З-фосфоглицериновый альдегид
По мере дальнейшего превращения фосфоглицеринового альдегида новые количества его образуются в процессе изомеризации фосфодиоксиацетона.
5. Последующим этапом является окисление двух молекул З^фосфоглицеринового альдегида. Эта реакция катализируется триозофосфатдегидрогеназой (1.2.1.12), коферментом которой является НАД (никотинамид-аденин-динуклеотид). В окислении участвует фосфорная кислота среды. Реакция протекает по следующему уравнению: 2СН 2 0 (Н 2 Р0 3) СНОНСНО + 2Н 3 Р0 4 + 2НАД Триозофосфатдегидрогеназа ->
З-фосфоглицериновый альдегид
->- 2СН 2 0 (Н 2 Р0 3) СНОНСОО w (H 2 P0 3) + 2НАД Н 2 (5)
1,3-дифосфоглицериновая йислота
Молекула 3-фосфоглицеринового альдегида присоединяет фосфат, а водород переносится на кофермент НАД, который восстанавливается. Энергия, освобождающаяся в результате окисления 3-фосфоглицеринового альдегида, аккумулируется в макроэргической связи образующейся 1,3-дифосфоглицериновой
6. Далее фосфатный остаток 1,3-дифосфоглицериновой кисло
ты, содержащий макроэргическую связь, при участии фермента
фосфоглицераткиназы (2.7.2.3) переносится на молекулу АДФ.
Образуется 3-фосфоглицериновая кислота, а АДФ, приобретая
дополнительную макроэргическую связь, превращается в АТФ:
2СН 2 0 (Н 2 Р0 3) СНОНСОО со (Н 2 Р0 3) + 2АДФ->2СН 2 0 (Н 2 Р0 3) CHOHCOOH+
1,3-дифосфоглицериновая кислота 3-фосфоглицериновая кислота
7. Затем под действием фермента фосфоглицеромутазы
(2.7.5.3) остаток фосфорной кислоты перемещается от третьего
углерода ко второму, и в результате 3-фосфоглицериновая кис
лота превращается в 2-фосфоглицериновую кислоту:
2СН 2 (Н 2 Р0 3) CHOHCOOH ^t 2CH 2 0HCH0 (Н 2 Р0 3) СООН. (7)
3-фосфоглицериновая кислота 2-фосфоглицериновая кислота
8. Следующей стадией является дефосфорилирование 2-фос-
фоглицериновой кислоты. При этом 2-фосфоглицериновая кис
лота под действием фермента энолазы (4.2.1.11) путем дегидра
тирования (потери воды) превращается в фосфоэнолпировино-
градную кислоту:
2СН 2 ОНСНО (Н 2 Р0 3) СООН qt 2СН 3: СО со (Н 2 Р0 3) СООН + 2Н 2 0. (8)
2-фосфоглицериновая кислота Сосфоэнолпировиноградная кислота
При этом превращении происходит перераспределение внутримолекулярной энергии и большая ее часть аккумулируется в макроэргической фосфатной связи.
9. Весьма нестойкая фосфоэнолпировиноградная кислота
легко дефосфорилируется, при этом остаток фосфорной кислоты
под действием фермента пируваткиназы (2.7.1.40) передается
вместе с макроэргической связью молекуле АДФ. В результате
образуется более устойчивая кетоформа пировиноградной кисло
ты, а АДФ превращается в АТФ:
2СН 2: СО сю (Н 2 Р0 3) СООН + 2АДФ -* 2СН 3 СОСООН + 2АТФ. (3)
Фосфоэнолпировиноградная Пировиноградная
кислота кислота
10. Пировиноградная кислота под действием фермента пи-
руватдекарбоксилазы (4.1.1.1) декарбоксилируется с отщепле
нием С0 2 и образованием уксусного альдегида:
2CH 3 COCOOH -*2С0 2 + 2СН 3 СНО. (10)
Пировиноградная Уксусный альдегид
11. Уксусный альдегид при участии фермента алкогольдегид-
рогеназы (1.1.1.1) взаимодействует с НАД-Н 2 , образовавшимся
ранее при окислении фосфоглицеринового альдегида в фосфо-
глицериновую кислоту [см. уравнение (5)]. В результате уксус
ный альдегид восстанавливается в этиловый спирт, а кофермент
НАД-Н 2 вновь регенерируется (окисляется в НАД):
2СН 3 СНО + 2НАД Н 2 Z 2СН 3 СН 2 ОН + 2НАД. (11)
Итак, завершающим этапом брожения является реакция восстановления уксусного альдегида в этиловый спирт.
Из рассмотренного цикла реакций спиртового брожения видно, что из каждой молекулы глюкозы образуется 2 молекулы спирта и 2 молекулы С0 2 .
В процессе спиртового брожения образуется четыре молекулы АТФ [см. уравнения (6) и (9)], но две из них затрачиваются на фосфорилирование гексоз [см. уравнения (1) и (3)]. Таким образом, запасается всего 2 г-моль АТФ.
Ранее указывалось, что на образование каждой грамм-молекулы АТФ из АДФ затрачивается 41,9 кДж, а в энергию двух молекул АТФ переходит соответственно 83,8 кДж. Следовательно, при сбраживании 1 г-моль глюкозы дрожжи получают энергии около 84 кДж. В этом и заключается биологический смысл брожения. При полном расщеплении глюкозы на С0 2 и воду выделяется 2874 кДж, а при окислении 1 г-моль глюкозы до С0 2 и Н 2 0 в процессе аэробного дыхания аккумулируется 2508 кДж, так как образующийся этиловый спирт еще сохраняет в себе потенциальную энергию. Таким образом, с энергетической точки зрения брожение - процесс малоэкономичный.
Сбраживание отдельных Сахаров происходит в определенной последовательности, обусловленной скоростью их диффузии в дрожжевую клетку. Быстрее всех сбраживаются дрожжами глюкоза и фруктоза. Однако сахароза как таковая исчезает в сусле (инвертируется) еще в начале брожения. Она гидролизу-ется р-фруктофуранозидазой (3.2.1.26) оболочки дрожжевых клеток с образованием гексоз (глюкозы и фруктозы), которые легко используются клеткой. Когда в сусле почти не остается фруктозы и глюкозы, дрожжи начинают потреблять мальтозу.
Атлас производственных спиртовых дрожжей Saccharomyces cerevisiae расы XII может служить справочным пособием для работников спиртовых заводов, обеспечивающих микробиологический контроль производства. В настоящее время при промышленном производстве продуктов питания с использованием дрожжей применяют, в основном, дрожжи вида Saccharomyces cerevisiae. При производстве хлеба, спирта, вина, хлебного кваса используют различные штаммы (расы) дрожжей. Даже сырье спиртовых заводов (зерно или меласса) влияет на выбор того или иного штамма. При производстве спирта из зерна чаще применяют дрожжи XII расы, постоянным местом обитания которых являются искусственно приготовляемые гидролизованные крахмалистые субстраты. Ведение технологии требует внимательного наблюдения за состоянием дрожжей и наличием посторонних микроорганизмов по участкам производства. Существующие методики позволяют проводить необходимый микроскопический анализ, но без определенной практики сложно идентифицировать полученные данные микроскопического анализа и регламентных показателей технологии.
Как известно, именно дрожжи превращают вещества зерна в этиловый спирт, и их можно рассматривать как одно из многочисленных орудий труда человека, а дрожжевую ферментацию - один из самых древних микробиологических процессов, используемых человеком в своих целях. Первое упоминание о применении дрожжей человеком относится к 6000 г. до нашей эры. Научное изучение дрожжей началось в 1680 г. после изобретения светового микроскопа. Исследователи различных стран описали внешний вид дрожжевых клеток; показали, что дрожжи - это живые организмы; доказали их роль при превращении сахара в спирт; получили чистые культуры дрожжей; классифицировали дрожжевые клетки по способу размножения, потреблению питательных веществ и внешнему виду. Современные оптические микроскопы оснащены сухими и иммерсионными объективами. Оптический микроскоп с сухим объективом позволяет изучать микроорганизмы размером более 5 мкм, иммерсионный микроскоп применяют при исследовании более мелких микроорганизмов. Изобретение электронного микроскопа позволило понять структуру дрожжевой клетки и изучить проявления её генетической системы, поскольку разрешающая способность электронного микроскопа 1,0-0,14 нм.
Микроскоп - незаменимый прибор при производстве спирта и без него невозможно эффективное ведение технологии: с его помощью определяют количество дрожжевых клеток в 1 мл дрожжевой или бродящей массы; процентное количество почкующихся и мертвых клеток; наличие посторонних микроорганизмов; содержание гликогена в клетках (упитанность клеток). Физиологическое состояние дрожжей устанавливают по внешнему виду клеток, что позволяет использовать дешевые световые микроскопы с сухими объективами. Следует отметить, что современное производство спирта не требует микроскопического анализа структуры дрожжевых клеток, однако при изучении внешнего вида клетки под световым микроскопом необходимо иметь представление и ее строении.
Строение дрожжевой клетки
Дрожжевые клетки имеют округлую или эллипсовидную форму с размером в поперечнике от 2,5 до 10 мкм и от 4,5 до 21 мкм в длину. На рис. 1 приведено графическое изображение среза дрожжевой клетки. Клеточная стенка, клеточная мембрана, ядро, митохондрии, вакуоли - структуры клетки, видимые в световой микроскоп с сухим объективом при использовании специфических красителей.
Клеточная стенка представляет собой жесткую структуру толщиной 25 нм, составляет около 25% сухой массы клетки и состоит в основном из глюкана, манана, хитина и белка. Организация клеточной стенки недостаточно изучена, однако современные теории отдают предпочтение модели трехслойной структуры, согласно которой внутренний глюкановый слои отделен от внешнего мананового промежуточным слоем с повышенным содержанием белка.
Клеточная мембрана (плазмалемма) дрожжевой клетки под электронным микроскопом выглядит как трехслойная структура, тесно прилегающая к внутренней поверхности клеточной стенки, и состоит примерно из равного количества липидов и белков, а также небольшого количества углеводов. Клеточная мембрана выполняет роль барьера проницаемости вокруг содержимого клетки и контролирует транспорт растворенных веществ внутрь клетки и из нее.
В изучении ядра достигнуты лишь некоторые успехи, поскольку индивидуальные хромосомы очень малы и не выявляются в виде дискретных структур ни в световом, ни в электронном микроскопах. Дрожжевые клетки имеют одно ядро размером от 2 до 20 мкм. Ядерная мембрана остается неизменной на протяжении всего клеточного цикла. Под электронным микроскопом она выглядит как двойная мембрана, усеянная порами.
Митохондрии - самые большие из клеточных включений сферической или цилиндрической формы размером в поперечнике от 0,2 до 2 мкм и от 0,5 до 7 мкм в длину. Двухслойная оболочка имеет толщину около 20 нм. Количество митохондрий в клетке более или менее постоянно и характерно для данного вида микроорганизмов.
Рис. 1. Графическое изображение среза дрожжевой клетки (в 1 сантиметре 1 микрометр)
Оно меняется в зависимости от стадии развития клетки и функциональной активности от 500 до 2000 тт. Функции митохондрий связаны с переносом электронов, ионов, субстратов внутри клетки. Помимо этого в митохондриях синтезируются вещества, аккумулирующие химическую энергию клетки.
Зрелые дрожжевые клетки содержат большую вакуоль. При образовании почки вакуоль, по всей вероятности, дробится на более мелкие вакуоли, которые распределяются между материнской клеткой и почкой. В дальнейшем эти маленькие вакуоли снова сливаются, образуя по одной вакуоли в материнской и дочерней клетках. Функция вакуоли точно не установлена. В ней содержатся гидролитические ферменты, полифосфаты, липиды, ионы металлов и др. Вакуоль, возможно, выполняет функции резервуара для хранения питательных веществ и гидролитических ферментов.
Внутриклеточное содержимое дрожжевой клетки (за исключением ядра, митохондрий и вакуоли), как известно, называют цитоплазмой, состоящей из воды, липидов, углеводов, различных высокомолекулярных и низкомолекулярных соединений, минеральных солей и др. Исследование клетки под электронным микроскопом показало сложную структуру цитоплазмы в виде гранул, функции и химические свойства которых достаточной мало не изучены. Цитоплазма играет важную роль в биохимии клетки и находится в тесном взаимодействии с органеллами, которые она окружает.
Отличительная особенность популяции растущих дрожжевых клеток - наличие почек, образующихся при делении клеток. Дочерняя клетка возникает в виде маленькой почки, которая растет в течении большей части клеточного цикла. Рост дрожжей происходит в основном во время формирования почек, поэтому почка к моменту её отделения становится по размеру более или менее такой же, как зрелая клетка (см. рис. 2). Клетки могут разойтись вскоре после деления, однако часто ещё до их расхождения начинаются новые циклы клеточного деления, в результате чего образуются группы клеток. На месте отделения клеток друг от друга остаются следы, называемые у материнской клетки дочерним шрамом, а у дочерней клетки - родовым шрамом. На одном и том же месте клеточной стенки никогда не появляются две почки. Каждый раз почка оставляет новый дочерний шрам на стенке материнской клетки. По числу шрамов можно определить, сколько почек образовала данная клетка, что позволяет оценить возраст клетки. Установлено, что у гаплоидных клеток насчитывается максимально 18, а диплоидных - 32 почечных шрама.

Рис. 2. Графическое изображение почкующейся клетки.
Методы световой микроскопии и микробиологического контроля, используемые в технологии спирта.
В технологии спирта при проведении микроскопического анализа популяции дрожжей световым микроскопом с сухим объективом рассматривают внешний вид клеток методом раздавленной капли в неокрашенном или окрашенном видах (прижизненные препараты), производят подсчет общего количества клеток и процентного количества почкующихся клеток, определяют наличие посторонних микроорганизмов.
Метод раздавленной капли
На предметное стекло наносят каплю исследуемой взвеси с дрожжевыми клетками, которую сверху накрывают покровным стеклом. Полученный образец рассматривают под микроскопом, где микроорганизмы видны в различных плоскостях. Данный метод прост, его применяют при изучении подвижности и внутреннего строения клеток микроорганизмов. Метод раздавленной капли без использования красителей позволяет различать дрожжевые клетки по толщине клеточных стенки и мембраны, состоянию цитоплазмы, наличию или отсутствию вакуолей, процентному количеству почкующихся и мертвых клеток, присутствию молочнокислых бактерий.
Подсчет процентного количества почкующихся клеток
Для определения количества почкующихся клеток на предметное стекло наносят по одной капле дрожжевой суспензии без твердых включений и дистиллированной воды, закрывают покровным стеклом, излишек жидкости отбирают листком фильтровальной бумаги и микроскопируют. У зрелых дрожжей почкуется более 10% клеток.
Пример. Всего в 5 полях зрения обнаружено 33+35+29+32+30=159 дрожжевых клеток, в т. ч. почкующихся 4+5+3+5+3=20. Процентное количество почкующихся клеток составляет 20 х 100/159 = 12,5 (%).
Измерение величин микроорганизмов
Единицей измерения величины микроорганизмов служит микрон (мкм), равный 0,001 миллиметра (мм). При измерении пользуются окуляр-микрометром - круглым стеклом с нанесенной на него шкалой (каждый миллиметр шкалы разделен на 10 делений). Стекло накладывают на диафрагму окуляра так, чтобы сторона с делениями оказалась вверху. Для тарирования значений одного деления окуляр-микрометра используют объект-микрометр, который помещают на столик микроскопа и рассматривают как препарат. Объект-микрометр представляет собой стеклянную пластинку со шкалой, одно деление которой равно 0,01 мм (или 10 мкм). На рис. 3 показано поле зрения микроскопа со шкалами окуляр-микрометра и объект микрометра. По совпадению делений обоих шкал устанавливают масштабный коэффициент для определения истинного значения одного деления окуляр-микрометра. На рисунке с делениями объект-микрометра совпали деления окуляр-микрометра №2 и №8, или 30 делений окуляр-микрометра совпали с 5 делениями объект микрометра (составляющими 50 мкм). Таким образом, одно деление окуляр-микрометра примерно равно 1,67 мкм (50/ 30=1,666...). Если вместо объект-микрометра на столик микроскопа поместить препарат с живыми дрожжами, можно определить их видимые размеры (длину и ширину), рассматривая препарат в те же объектив и окуляр и с тем же выдвижением тубуса. Для этого необходимо установить, какому числу окулярных делений соответствует величина измеряемого объекта, и затем это число умножить на полученное значение масштабного коэффициента (в нашем случае равным 1,67 мкм). Полученные результаты измерений не поддаются математической обработке в соответствии с теорией эксперимента, однако они дают представление о размерах изучаемых микроорганизмов.
Подсчет количества клеток
Для подсчета количества дрожжевых клеток пользуется счетной камерой Горяева представляющей собой толстое предметное стекло с нанесенными на него поперечными прорезями. которые образуют три поперечно расположенные

Рис. 3. Шкалы объект-микрометра и объектив микрометра для измерения величин микроорганизмов под микроскопом
площадки. Средняя из них разделена на две части, на каждой из которых выгравирована сетка (см. рис. 5) площадью 9 мм 2 , разделенная на 225 больших квадратов площадью 0,04 мм 2 каждый (15 рядов по 15 квадратов) и 400 малых квадратов площадью 0,0025 мм 2 каждый (каждый третий ряд больших квадратов в горизонтальном и вертикальном направлении разделен на 16 малых квадратов). Средняя площадка предметного стекла опущена на 0,1 мм относительно двух других площадок, на которые накладывают специальное шлифованное покровное стекло размером 18x18 мм, что обеспечивает создание камеры для дрожжевой суспензии. Количество клеток определяют в соответствии с формулой О = А х К 1 х К 2 х В, где В количество клеток в 1 мл суспензии, шт/мл; А количество клеток в 80 малых квадратах, шт.; К., коэффициент глубины камеры (при глубине камеры 0.1 мм
Рис. 4. Камера Горяева: 1 - предметное стекло; 2 - специальное покровное стекло; 3 - камера для дрожжевой суспензии; 4, 6 - площадка для покровного стекла; 5 - сетка для подсчета дрожжевых клеток; 7 - прорезь для введения дрожжевой суспензии
К 1 = 10; при глубине камеры 0,2 мм К 1 = 5); К 2 -коэффициент пересчета объема, 1/мл (К 2 = 5000 1/ мл); В - коэффициент разбавления пробы (для дрожжей В=10). При подсчете дрожжевых клеток в камере Горяева с глубиной 0,1 мм и десятикратным разбавлением дрожжевой суспензии В = 5 х 10 4 А х В.
В зрелых дрожжах и сбраживаемом сусле (во время главного брожения) количество дрожжевых клеток превышает 80 млн шт/мл.
Подсчет процентного количества мёртвых клеток в дрожжевой суспензии
Для определения количества мёртвых клеток на предметное стекло наносят по одной капле не фильтрованной дрожжевой суспензии и раствора метиленовой сини (1:5000), окрашивающей мертвые клетки в синий цвет. Каплю закрывают покровным стеклом, излишек жидкости собирают листком фильтровальной бумаги и через 2 мин микроскопируют. В поле зрения микроскопа считают общее количество дрожжевых клеток, затем только синие, после чего препарат передвигают и подсчет ведут в новом поле зрения. Таким образом подсчитывают общее количество клеток в пяти полях зрения. После подсчета вычисляют количество мертвых клеток в процентах. В зрелых дрожжах количество мёртвых клеток не должно превышать 1%. Пример. Всего в пяти полях зрения обнаружено 43+45+39+42-40=209 дрожжевых клеток, в т. ч. окрашенных в синий цвет 1 +0+0+0+1=2. Процентное количество мёртвых клеток составляет 2 х 100/209 = 0,96 (%).
Рис. 5. Сетка для подсчета дрожжевых клеток в камере Горяева: 1 - большой квадрат; 2 - малый квадрат
Определение содержания гликогена в дрожжевых клетках
При нормальной технологии в дрожжах накапливается гликоген, когда 2/3 сахара сусла сброжены и дрожжи пригодны для использования в производстве. Для определения количества гликогена в дрожжевых клетках на предметное стекло наносят каплю нефильтрованной дрожжевой суспензии и 2 капли 0,5%-ного раствора йода (0,5 г йода и 1 г KJ на 100 мл воды), капли смешивают, накрывают покровным стеклом, отбирают излишек жидкости листком фильтровальной бумаги и микроскопируют. При соотношении дрожжевой суспензии и раствора йода 1:2 через 2-3 мин клетки окрашиваются в светло-желтый цвет, а гликоген - в коричневый. Применять более крепкий раствор йода, чем 1%-ный, нельзя, так как он окрашивает в коричневый цвет не только гликоген, но и всю клетку. У зрелых дрожжей гликоген занимает от 1/3 до 2/3 клеток.
Определение бактериальной инфекции
Для определения процентного содержания бактериальной инфекции (в первую очередь молочнокислых бактерий) из пробы дрожжей берут одну каплю дрожжевой суспензии без твердых включений и помещают ее на предметное стекло, куда добавляют одну каплю дистиллированной воды. Обе капли смешивают и накрывают предметным стеклом, удаляя излишек жидкости листком фильтровальной бумаги, и микроскопируют. Поскольку производственные дрожжи ведут в нестерильных условиях по методу естественно чистой культуры, то в них всегда можно обнаружить некоторое количество бактерий. При нормальной технологии в сернокислых дрожжах в поле зрения микроскопа (с объективом х40 и окуляром х7 и более) находят от 1 до 3 клеток бактерий, среди которых обычно не бывает подвижных форм. Наличие в поле зрения микроскопа большего количества бактерий говорит о нарастании кислотности в производственных дрожжах или в сбраживаемом сусле. Спороносные подвижные формы бактерий при закисании дрожжевого затора обычно не развиваются вследствие накопления этилового спирта.
Внешний вид дрожжевых клеток
Покоящиеся дрожжи чистой культуры, молодые, зрелые, старые, голодающие и мертвые клетки можно определить по их размерам и форме, строению и внутреннему содержимому.
Размер и форма дрожжевых клеток
В среднем размеры клеток дрожжей расы XII составляют 6x9 мкм, однако в зависимости от условий среды, возраста и условий развития (кислотность, доступ кислорода и т.п.), их фактические размеры имеют отклонения в большую и меньшую стороны. Формы дрожжей одной расы определяются, в основном, условиями развития. Клетки имеют овальную форму при культивировании на зерновом сусле; при росте на твердой среде все расы дрожжей дают более или менее вытянутые клетки; несколько удлиненную форму имеют также дрожжи в момент интенсивного развития.
Строение и внутреннее содержимое клетки
При микроскопическом анализе дрожжевых клеток следует обращать внимание на толщину оболочек; вид цитоплазмы; наличие в клетки вакуолей и гликогена; количество в популяции мёртвых клеток. У молодых клеток толщина оболочки мало заметна, а у старых выступает в виде хорошо видимого ободка, который при дальнейшем старении становится двуконтурным. Вид цитоплазмы может быть однородный или зернистый. Зернистость большей частью характерна для старых, больных и развивавшихся в ненормальных условиях (высокая температура или перемена температур, высокая кислотность, инфекция) клетках. Отставание цитоплазмы от оболочки клетки бывает при плазмолизе или свидетельствует о разрушении клетки. Количество гликогена в дрожжах непостоянно и зависит от их возраста. Наибольшее количество гликогена накапливается у зрелых дрожжей.
Вид дрожжевых клеток под объективом микроскопа в зависимости от их возраста
|
Внешний вид и содержимое клеток |
Возраст дрожжевых клеток |
|||||
|
Покоящиеся (чистая культура) |
Молодые (незрелые) |
Зрелые |
Перезрелые (старые) |
Голодающие |
Мертвые |
|
|
Овальная |
Овальная |
Овальная |
Клетки съеживаются |
Клетки съеживаются |
||
|
Размер |
Крупные |
Уменьшаются в размерах |
Уменьшаются в размерах |
|||
|
Почкующиеся клетки |
Нет или единичные |
Почкуется 10 % |
Почкуется 10 % |
Нет или единичные |
||
|
Оболочка |
Очень тонкая |
Очень тонкая |
Четко очерченная |
Толстая или двуконтурная |
Толстая или двуконтурная |
Расплывается и распадается |
|
Цитоплазма |
однородная |
Нежная и однородная |
Неоднородная или зернистая |
Сильно зернистая |
Сильно зернистая |
Комковатая |
|
Вакуоли |
Иногда занимает всю клетку |
|||||
|
Гликоген |
В единичных клетках |
Занимает меньше 1/4 клетки или отсутствует |
Занимает от 1/3 до 2/3 клетки |
В небольших количествах |
Отсутствует |
Отсутствует |
Вид дрожжевых клеток в зависимости от возраста
У молодых дрожжей оболочка очень тонкая, цитоплазма нежная и однородная. Вакуолей нет или видны малые вакуоли у небольшого количества клеток. Гликоген в единичных клетках. Зрелые дрожжи имеют четко очерченные оболочки. Заметно 10-15% клеток с почками. В цитоплазме видна неоднородность, зернистость, появляются средние по величине вакуоли, в клетках содержится много гликогена. Количество мёртвых клеток не превышает 1%. У перезрелых дрожжей отчетливо видна толстая оболочка при сильной зернистости цитоплазмы. Большие вакуоли занимают почти всю клетку. Если дрожжам не хватало питательных веществ, то клетки уменьшаются в размерах. Почкуются единичные клетки. Процент мёртвых клеток по мере старения прогрессивно увеличивается.
Оболочки голодающих дрожжей толстые (у некоторых клеток оболочки имеют переменную толщину), их содержимое зернисто. Клетки уменьшаются в размерах, съёживаются, немного удлиняются. Вакуоли отсутствуют, гликогена нет. Отмирание и разрушение дрожжей происходит в несколько стадий. Цитоплазма становится комковатой, но прилегает к хорошо видимой оболочке. Затем оболочка расплывается и распадается. Протоплазма становится ещё более зернистой и распадается на мелкие части. Иногда оболочка остаётся, но протоплазма отстаёт от неё, собирается комком в центре, клетка удлиняется, принимает неправильную форму и разрушается. В таблице приведены данные о внешнем виде дрожжевых клеток в зависимости от их возраста.
Внешний вид дрожжевых клеток при дрожжегенерации
При пуске завода (при освоении производства, в начале сезона или при инфицировании оборудования) дрожжи готовят из чистой культуры, поступающей на завод в пробирке. Разведение чистой культуры производят путем последовательного переноса клеток из пробирки в колбу емкостью 500 мл, затем в пятилитровую бутыль и маточник, откуда дрожжи поступают в дрожжанку, где приготавливают производственные дрожжи.
Чистая культура дрожжей
На рис. 6 приведено изображение поля зрения микроскопа с дрожжевыми клетками, перенесенными из пробирки с чистой культурой в колбу с суслом. Оболочки клеток очень тонкие, цитоплазма нежная и однородная, вакуолей нет. В поле зрения микроскопа нет молочнокислых бактерий, что говорит о хорошем качестве чистой культуры дрожжей. На рис. 7 дрожжи из колбы 500 мл после 24 ч роста. Тонкие оболочки, однородная цитоплазма клеток и отсутствие в ней вакуолей говорят о молодости дрожжей. Отсутствие молочнокислых бактерий в поле зрения микроскопа и большое количество делящихся клеток (более 15%) ещё раз подтверждают хорошее качество чистой культуры.
Производственные дрожжи
Качество дрожжей перед передачей их в производство определяют по количеству почкующихся клеток, наличию в дрожжах молочнокислых бактерий, количеству мёртвых клеток, упитанности дрожжей (количество гликогена в клетках), количеству клеток в 1 мл дрожжей. На рис. 8-11 приведены изображения полей зрения микроскопа с пробами зрелых дрожжей из одной дрожжанки при определении их качества перед передачей в производство.
На всех изображениях крупные клетки овальной формы с четко очерченными оболочками и зернистой цитоплазмой. Почкуется более 10% клеток, а в поле зрения микроскопа не более 3 клеток молочнокислых бактерий (см. рис. 8). Количество мёртвых клеток не превышает 1% (см. рис. 9). Содержание гликогена говорит об упитанности дрожжей (см. рис. 10). Количество дрожжевых клеток составляет 120 млн. шт./мл (см. рис.-11). На основании проведенного анализа можно сделать только один вывод: дрожжи в дрожжанке хорошего качества и их можно передавать в производство.
В некоторых случаях происходит инфицирование дрожжей, в первую очередь молочнокислыми бактериями. На рис. 12 приведено изображение поля зрения микроскопа с пробами зрелых инфицированных дрожжей. Крупные клетки овальной формы с четко очерченными оболочками и зернистой цитоплазмой. Почкуется значительное количество клеток, однако в поле зрения микроскопа больше 3 клеток молочно кислых бактерий. Подобные дрожжи не пригодны для использования в производстве.
При остановке спиртовых заводов (отсутствие сбыта готовой продукции или капитальный ремонт) дрожжи хранятся при температуре 10...12°С в течение нескольких месяцев. На рис. 13 приведено изображение поля зрения микроскопа с пробой захоложенных дрожжей из дрожжанки, которые хранились при температуре 7... 10 °С в течение 45 сут. Дрожжевые клетки различаются по размерам и форме. Одни клетки имеют овальную форму и гонкие оболочки с однородной цитоплазмой, как молодые или зрелые клетки. Другие клетки потеряли форму, оболочки толстые переменной толщины, цитоплазма сильно зернистая, что позволяет отнести их к голодающим и перезрелым клеткам. Захоложенные дрожжи применяют в производстве. На рис. 14 приведено изображение поля зрения микроскопа с пробой зрелых дрожжей из дрожжанки, при выращивании которых использовали захоложенные дрожжи. Клетки крупные, овальной формы, с четко очерченными оболочками и зернистой цитоплазмой. Некоторые клетки почкуются, количество клеток молочнокислых бактерий не превышает нормы. Две клетки имеют разрушенные оболочки. По всей вероятности, это остатки клеток захоложенных дрожжей. Дрожжи пригодны для использования в производстве.

Рис. 6. Чистая культура дрожжей

Рис. 7. Чистая культура дрожжей спустя 1 сутки

Рис. 8. Зрелые дрожжи из дрожжанки

Рис. 9. Зрелые дрожжи (подсчет процентного количества мертвых клеток)

Рис. 10. Зрелые дрожжи (определение упитанности дрожжей)

Рис. 11. Зрелые дрожжи (подсчет количество клеток в одном миллилитре дрожжей)

Рис. 12. Зрелые инфицированные дрожжи

Рис. 13. Зрелые дрожжи из дрожжанки после 45-суточного хранения при температуре 7.. .12 °С

Рис. 14. Зрелые дрожжи из дрожжанки, выращенные из захоложенных дрожжей
Внешний вид дрожжевых клеток при сбраживании сусла
При сбраживании сусла проведение микроскопического анализа целесообразно в случае нарастания титруемой кислотности бражки при брожении более чем на 0,2 °К (закисании бражки). На рис. 15 приведено изображения поля зрения микроскопа с пробой из закисшего бродильного чана (периодическая схема сбраживания сусла, 72 ч брожения). Поскольку сбраживание сусла окончено, то анализ внешнего вида и внутреннего содержимого дрожжевых клеток не дает результата. Большое количество молочнокислых бактерий в поле зрения микроскопа говорит о бактериальном закисании бродильного чана.

Рис. 15. Инфицированная бражка из бродильного чана
В настоящее время спиртовые заводы применяют несколько технологических схем производства спирта из зерна, отличающихся температурой тепловой обработки сырья: с использованием аппаратов типа «Генц» - до 165 °С; агрегатов непрерывного разваривания (Мичуринская схема) - до 150 °С; аппаратов гидродинамической обработки замеса - до 95 °С. Помимо этого спиртовые заводы применяют различные осахаривающие материалы: солод; неочищенные ферментные препараты, получаемые в условиях спиртового завода; очищенные ферментные препараты, производимые специализированными биохимическими заводами. Способы тепловой обработки замеса и используемые ферментные препараты влияют на все технологические показатели, в т. ч. на показатели приготовления дрожжей и сбраживания сусла. В атласе даны рекомендации по использованию микроскопического анализа при производстве спирта из зерна с применением аппаратов гидродинамической обработки замеса, очищенных ферментных препаратов и сернокислых дрожжей.
Инфицирование чистой культуры дрожжей
Микроскопический анализ пробы дрожжей из пробирки с чистой культурой или колбы после 20 ч роста показал наличие в полях зрения микроскопа молочнокислых бактерий. Чистая культура дрожжей инфицирована (как правило, это происходит при длительном хранении в условиях высоких температур). Необходимо поменять чистую культуру дрожжей. При повторном выявлении инфекции в чистой культуре целесообразно поменять поставщика чистой культуры дрожжей.
Инфицирование производственных дрожжей
Микроскопический анализ пробы зрелых дрожжей из дрожжанки показал наличие в поле зрения микроскопа более 3 клеток молочнокислых бактерий, что говорит об инфицировании зрелых дрожжей. Инфицирование дрожжей происходит в результате следующих основных причин: использование некачественного зерна; применение воды из открытых водоемов (особенно в теплое время года); использование некачественных ферментных препаратов; некачественная мойка и стерилизация оборудования и трубопроводов; нарушения регламентных показателей приготовления дрожжей; эксплуатация устаревшего оборудования на заводе.
В себестоимости спирта стоимость зерна занимает 40-60% и использование дешевого зерна улучшает экономические показатели производства. Однако при применении некачественного сырья возникают потери спирта в результате инфицирования. Целесообразно использовать зерно с качеством не ниже первой степени дефектности: зерно, вышедшее из стадии покоя; проявляющее усиленные физиологические процессы (дыхание), способствующие жизнедеятельности микроорганизмов; имеющее солодовый или гнилистый запахи, однако пригодное для производства. При необходимости переработки некачественного зерна температуру тепловой обработки замеса следует повысить до 130...135 °С.
При применении воды из открытых водоемов в теплое время года температуру тепловой обработки замеса можно повысить до 130...135 °С. Предпочтительно использовать воду питьевого качества из водопровода или артезианской скважины. Целесообразно применять способы обеззараживания воды или замеса путем их обработки магнитными и другими излучениями, используемыми в пищевой и медицинской промышленностях при обработке продуктов питания и медицинской техники.
Если не удается найти источник инфицирования зрелых дрожжей, то проверяют ферментные препараты на их бактериальную зараженность. В первую очередь инфицированными оказываются ферменты. производимые в условиях спиртовых заводов и неочищенные (в жидком виде) транспортируемые автомобильным или железнодорожным транспортом (особенно в жаркое время года). При инфицировании ферментных препаратов их заменяют на качественные и меняют поставщика ферментов.
Мойку оборудования при дрожжегенерации осуществляют щетками и водой из шлангов (давление 3-4 кг/см 2) с последующей стерилизацией паром. Расход пара составляет 10-12 кг на 1 м дрожжанки при 30-минутном пропаривании. Мойку трубопроводов проводят различными моечными растворами с последующей стерилизацией паром. Наиболее сложные для мойки и стерилизации внутренние змеевики. Змеевики охлаждения дрожжанок целесообразно заменить на рубашки охлаждения, а мойку внутренней поверхности проводить теплой водой поддавление 120-150 кт/см: с использованием очистителей высокого давления. Наибольший эффект от применения подобных очистителей достигается при мойке сварных стыковых и угловых швов внутри оборудования, а также при мойке внутренней поверхности дрожжанок с коррозионными раковинами. Использование очистителей позволяет уменьшить расход пара и моющих растворов, а также исключить ручной труд при мойке внутренних поверхностей оборудования щетками.
Мойку и стерилизацию трубопроводов осуществляют в соответствии с регламентом. Наиболее затруднительны мойка и стерилизация теплообменников типа «труба в трубе», охлаждающих осахаренную массу с 52...60 °С (в зависимости от используемых ферментов) до 22...28 °С (в зависимости от применяемых дрожжей), особенно если часто происходит остановка насосов, перекачивающих замес в осахариватель, что приводит к задержке массы в теплообменнике. Теплообменник типа «труба в трубе» целесообразно заменить на пластинчатый теплообменник, который в десятки раз меньше по габаритам, изготовлен из нержавеющей стали и его легко мыть в разобранном состоянии и стерилизовать.
При приготовлении дрожжей необходимо придерживаться показателей технологического регламента. Наиболее трудно обеспечить подачу в змеевики дрожжанок достаточного количества воды (особенно в теплое время года) и без задержек передавать зрелые дрожжи в бродильный чан. Замена охлаждающих змеевиков на рубашку охлаждения позволяет в несколько раз увеличить поверхность охлаждения дрожжанки и при нехватке холодной воды достичь охлаждения дрожжевой массы до необходимой температуры. Имея значительную поверхность охлаждения в дрожжанках можно добиться своевременной подачи дрожжей в бродильный чан за счет изменения температуры дрожжегенерации. Снижение температуры дрожжегенерации до 25...27 °С обеспечивает увеличение сроков приготовления дрожжей, а увеличение температуры дрожжегенерации до 30...32 °С ускоряет приготовление дрожжей.
В технологии спирта емкостное оборудование, как правило, изготавливают из черной стали с толщиной стенок 5-8 мм. Большая толщина стенок позволяет использовать дрожжанки и трубопроводы до 25 лет без ремонта. За это длительное время на стенках дрожжанок по различным причинам образуются раковины (коррозия металла, кавитационные процессы в жидкости, усталость металла), которые плохо отмываются и способствуют инфицированию зрелых дрожжей. Необходимо вовремя менять оборудование (один раз в 6-7 лет эксплуатации) и, тем самым, исключать очаги инфицирования дрожжей.
Недостаточная упитанность дрожжевых клеток
Микроскопический анализ пробы зрелых дрожжей из дрожжанки показал, что гликоген в клетках занимает менее 1/4 внутреннего содержимого, а клетки дрожжей уменьшились в размерах. Указанное говорит о том, что дрожжи или не дозрели и их рано передавать в производство или они перестояли и клеткам необходимо дополнительное питание. В первом случае достаточно увеличить время дрожжегенерации. Во втором целесообразно проверить продолжительность гидродинамической обработки зернового замеса (полноту заполнения аппарата гидродинамической обработки замеса в соответствии с регламентом), от чего зависит количество растворимых сухих веществ сырья и, в особенности, растворение белков зерна, поскольку недостаток азотистого питания снижает бродильную активность дрожжей; правильность дозирования ферментов в осахаривателе. При недостатке азотистого питания можно, использовать карбомид, который учитывается и дозируется, исходя из содержания в нем азота.
Повышенное количество мертвых клеток
Микроскопический анализ пробы зрелых дрожжей выявил, что содержание мёртвых клеток превышает 1% от общего числа дрожжей. Сверхнормативное отмирание дрожжевых клеток происходит при повышении температуры во время дрожжегенерации выше регламентной (30 °С) или при повышении кислотности дрожжевого сусла (выше 1,1 °К). Целесообразно проконтролировать выполнение регламентных показателей дрожжегенерации.
Уменьшенное количество клеток в 1 мл дрожжей и недостаточное количество почкующихся клеток
Подсчет количества дрожжевых клеток под микроскопом показал, что их содержание в дрожжах 80 млн шт/мл, а подсчет количества почкующихся клеток выявил, что в поле зрения микроскопа менее 10% почкующихся дрожжей. Необходимо проверить выполнение всех регламентных показателей, качество зерна, ферментов, серной кислоты (определить наличие в ней мышьяка). Следует заменить некачественное сырьё и вспомогательные материалы.
Инфицирование сбраживаемого сусла
Микроскопический анализ пробы сбраживаемого сусла показал наличие большого количества молочнокислых бактерий. Следует ожидать уменьшение выхода спирта из 1 тонны зерна, поскольку питательные вещества сырья перерабатываются бактериями в молочную кислоту. Причинами инфицирования бражки могут быть: нарушение регламентных показателей при брожении; необоснованное увеличение времени сбраживания сусла, когда количество несброженных углеводов в бражке составляет менее 0,65 г/100 мл (при гидродинамической обработке замеса после 48-60 часов сбраживания), а бражка продолжает выдерживаться в бродильном чану до 72 часов; недостаток охлаждающей воды.
При нарушении регламентных показателей сбраживания сусла и необоснованном увеличении времени сбраживания достаточно провести организационные мероприятия, обеспечивающие технологическую дисциплину на предприятии. При недостатке охлаждающей воды необходимо осуществить технические мероприятия. Применение рубашек охлаждения вместо змеевиков позволяет в несколько раз увеличить поверхность охлаждения бродильных чанов, что значительно снижает потребление воды. На заводах, применяющих для охлаждения бражки выносные теплообменники типа «труба в трубе», целесообразно заменить их на пластинчатые теплообменники, что позволит более эффективно охлаждать бражку не изменяя температуру охлаждающей воды. Недостатки охлаждающей воды можно возместить снижением ее температуры, путем внедрения градирен и холодильных установок.
ЗАКЛЮЧЕНИЕ
При производстве спирта основным компонентом технологии служат дрожжи, требующие большого внимания и ответственного отношения обслуживающего персонала, что возможно только при помощи микроскопического анализа как отдельных клеток, так и дрожжевой популяции в целом. По внешнему виду клеток можно определить физиологическое состояние дрожжей и внести коррективы в технологию. Авторы считают, что приведенные в настоящем атласе изображения дрожжей под микроскопом облегчат работу обслживающего персонала спиртовых заводов при разведении чистой культуры дрожжей, дрожжегенерации и сбраживании сусла.
Литература
1. ГУ 9182-160-00008064-98. Чистая культура дрожжей. Расса XII.
2. Павлович С.А. Медицинская микробиология. -Минск: Вышейшая школа, 1997. 133 с.
3. Яровенко и др. Технология спирта. -М.: Колос, 1996. 464 с.
4. Терновский Н^С. и др. Ресурсосберегающая технология в производстве спирта. -М.: Пищевая промышленность, 1994. 168 с.
5. Сассон А. Биотехнология: свершения и надежды. -М.: Мир, 1987. 411 с.
6. Рухлядева А.П. и др. Инструкция по технохимическому и микробиологическому контролю спиртового производства. -М.: Агропромиздат, 1986. 399с.
7. Бачурин П.Я., Устинников Б.А. Оборудование для производства спирта и спиртопродуктов. -М.: Агропромиздат, 1985. 344 с.
8. Берри Д. Биология дрожжей. -М.: Мир, 1985. 95 с.
9. Коновалов С.А. Биохимия дрожжей. -М.: Пищевая промышленность, 1980. 272 с.
10. Селибер Г.Л. Большой практикум по микробиологии. -М.: Высшая школа, 1962. 420 с.
Для получения вкусного и расслабляющего напитка необходим основной ингредиент – пивные дрожжи . Именно они осуществляют процесс превращения сахаров сусла в спирт и углекислый газ. Поговорим о классификации пивоваренных дрожжей в этой статье.
Дрожжи – это одноклеточные грибки, которые размножаются путем отпочковывания дочерних клеток. Дрожжи применяются при выпечке хлеба, в виноделии и пивоварении, с их помощью производят крепкие алкогольные напитки и молочнокислые продукты. Пивные дрожжи являются основным компонентом рецептуры приготовления пива, который преобразует сахара сусла в спирты.
Пивные дрожжи – это природное белково-витаминное средство, которое применяют для лечения и профилактики различных заболеваний. Сухие пивные дрожжи содержат 50% белка, 25-40% углеводов и до 3% жира.
Белок пивных дрожжей характеризуется сбалансированностью аминокислот, близкой к животному белку, за исключением содержания аминокислоты метионина, которого в 2-3 раза меньше, чем в белке мяса и других животных продуктов. Он легко усваивается организмом человека.
Пивоваренные дрожжи насыщены витаминами группы В (B1, B2, РР, пантотеновой кислоты, B6), витаминами группы D.
Пивовары различают верховые дрожжи (прежде их относили к S. cerevisiae) и низовые дрожжи (относившиеся прежде к S. carlsbergensis и S. uvarum).
Дрожжи верхового брожения , используемые для производства эля, бродят при относительно высоких температурах (18-25 °С) и в конце брожения собираются на поверхности сброженного сусла.
Дрожжи низового брожения применяют для варки лагерного пива методом низового брожения. Температура брожения у них гораздо ниже (8-12 °С). В конце процесса брожения дрожжи оседают на дно бродильной емкости. Низовые дрожжи биохимически отличаются от верховых по утилизации мелибиозы и раффинозы. Относительно недавно были описаны и другие фенотипические различия между ними - в частности, модель смешанного сбраживания углеводов, транспорт углеводов и чувствительность к катионам. Сопоставление геномов некоторых штаммов низовых и верховых дрожжей показало, что у штаммов дрожжей верхового брожения наблюдается сильная изменчивость, то штаммы дрожжей низового брожения происходят, как правило, от одного-единственного штамма, полученного, скорее всего, гибридизацией S. cerevisiae верхового брожения и S. monacensis низового брожения. Некоторые особые типы пива получают из смесей дрожжевых культур, в которые могут входить дрожжи других родов, - в частности, Brettanomyces (например, в пиве Гёз (Gueuze) или даже молочнокислые бактерии (в пиве Gueuze, Berliner Weisse, в бельгийских кислых элях).
Расы пивных дрожжей.
Издавна были известны дрожжи верхового брожения , потому как брожение осуществлялось при обычной температуре (как в виноделии, хлебопечении). Желая получить напитки, насыщенные углекислым газом, стали проводить брожение при низких температурах. Под влиянием изменившихся внешних условий и были получены дрожжи низового брожения с иными свойствами.
В пивоварении применяют разновидности дрожжей, отличающихся друг от друга одной или несколькими признаками. Их получают из одной клетки. Такие культуры называют расами (штаммами).
Дрожжи верхового брожения в процессе интенсивного брожения всплывают на поверхность сбраживаемой жидкости, накапливаются в виде слоя пены и остаются в таком виде до конца брожения. Затем они опускаются на дно, образуя весьма рыхлый слой на дне бродильного аппарата. По своей структуре эти дрожжи относятся к пылевидным дрожжам, не слипающимися между собой в отличие от хлопьевидных низовых дрожжей, которые достаточно быстро слипаются и соответственно быстро осаждаются на дно.
Дрожжи низового брожения не переходят в поверхностный слой пива — пену, а быстро оседают на дне .
Способность дрожжей к хлопьеобразованию имеет определенное значение для технологии сбраживания пивного сусла , так как ускоряет осветление пива и облегчает съём дрожжей из бродильного аппарата после брожения с последующим использованием их в качестве семенных дрожжей. Низкая температура при брожении способствует хлопьеобразованию.
Кислотность среды сильно влияет на свойства дрожжей. Например, в кислой среде при рН менее 3 и в щелочной при рН более 8 хлопьевидные дрожжи становятся пылевидными. Хлопьевидные дрожжи по сравнению с пылевидными имеют более крупные клетки, меньше подвержены автолизу, дают большой прирост биомассы, обладают меньшей бродильной активностью, образуют меньше диацетила и высших спиртов в пиве, что положительно сказывается на его качестве.
Дрожжи низового брожения отличаются от дрожжей верхового брожения тем, что они полностью сбраживают раффинозу. Дрожжи низового брожения имеют оптимальную температуру для роста 25 — 27С, минимальную 2-3С, а при 60-65С они отмирают. Максимальное развитие низовых дрожжей происходит при рН 4,8-5,3. Кислород, растворенный в сусле, способствует размножению дрожжей, в то время как продукты брожения (этиловый спирт, диоксид углерода, высшие спирты, ацетальдегид, кислоты), а также повышенная концентрация сахара угнетают развитие низовых дрожжей.
Качественные пивоваренные дрожжи должны отвечать следующим требованиям:
— быстро сбраживать сусло,
— хорошо образовывать хлопья,
— осветлять пиво в ходе брожения,
— придавать пиву чистый вкус и приятный аромат.
К сильносбраживающим и легко дающим хлопья относятся пивные дрожжи низового брожения Фроберг (Saccharomyces cerevisiae Froberg), дрожжи рас V и 776.
На пивоваренных заводах большое распространение получили дрожжи расы 776, которая была выведена в начале XX в. Эти дрожжи считаются пригодными особенно для сбраживания сусла, сваренного с добавкой несоложеных материалов или из солода, полученного солодованием ячменей с невысокой степенью прорастаемости.
Пивные дрожжи верхового брожения находят широкое применение в Британии при приготовлении Портера. Они используются для приготовления Берлинского светлого пива и других напитков. Для приготовления Бархатного пива применяют штамм 191 К, интенсивно сбраживающий моносахариды и мальтозу, но не сбраживающий сахарозу, рафинозу и лактозу.
Итак, дрожжи для приготовления пива подбираются с учетом многих факторов, но самое важное — нужно использовать только качественный материал, у проверенных поставщиков и только тогда превосходное пиво Вам гарантированно!
